Cinética química
Existem diversos tipos de reações químicas, cada reação demanda um tempo determinado. A cinética é a parte da química que estuda a velocidade das reações e os fatores que influenciam nestas.
A velocidade média é calculada a partir do consumo dos reagentes e aparecimento dos produtos, este consumo é representado pelo número de mols de reagente/produto presentes na reação. Está representação é dada pela fórmula a seguir:

Já a velocidade média da reação é calculada a partir da velocidade média dos produtos/reagentes divididas pelos seus coeficientes estequiométricos, como demonstra a fórmula a seguir:
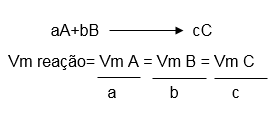
Na cinética química utilizamos gráficos para demonstrar o que ocorre na reação. Estes gráficos podem ser construídos em relação a:
- Concentração (mol/L) e tempo de reação (s, m ou h), que demonstra o consumo do reagente e a formação do produto em função do tempo;
Ex:
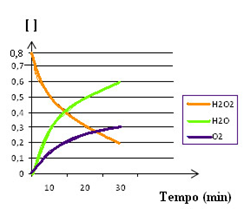
Fonte:https://mundoeducacao.bol.uol.com.br/quimica/analise-grafica-velocidade-das-reacoes.htm
-Caminho da reação e entalpia que demonstra o caminho da reação em geral, apontando a energia de ativação do produto e a variação de energia entre produto/reagente.
Ex:
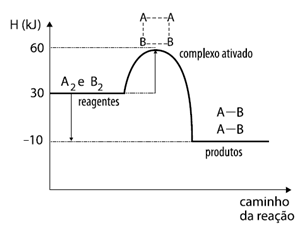
Fonte: https://quimicaevestibular.com.br/caderno-bom/lista-de-cinetica-quimica/
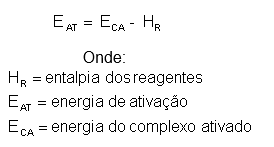
A energia de ativação (EA) é a energia mínima que deve ser fornecido para a formação do produto, ela é calculada atravésdo complexo ativado (ponto inicial da formaçãodo produto) e da entalpia inicial da reação:
Entretanto, existem diversos fatores que influenciam nestas reações, estes são:
-Temperatura: temperatura influencia na energia das moléculas, podendo diminuir o tempo da reação;
-Concentração: quanto maior a concentração de reagentes, mais rápida será a reação;
-Superfície de contato: quanto maior a superfície de contato dos reagentes, maior é a facilidade de ocorrer a reação, portanto, menor é a velocidade;
-Catalisador: o catalisadoratua na energia de ativação, diminuindo-a e, assim, tornando reação mais rápido. É importante lembrar que o catalisador não influencia na entalpia da reação, apenas em sua velocidade;
-Choques efetivos: quanto mais choques com energia e geometria adequada houver, maior a velocidade da reação, sendo que, a geometria adequada para o choque entre as moléculas é na vertical;
-Pressão: quanto maior a pressão exercida nos reagentes, maior a chance das colisões entre as moléculas acontecerem de forma adequada, já que este fator aumentaria os choques efetivos.
Já em relação as reações, existem dois tipos, a reação elementar que ocorre em apenas uma etapa e a reação global que ocorrem em mais de uma etapa. Os gráficos das reações globais devem ser interpretados de modo que a etapa determinante seja a mais lenta, ou seja, a velocidade média é determinada pela etapa com maior energia de ativação.